Tvålens kemi – Ren magi
Tvål är kemiskt sett ett alkaliskt salt som skapas genom att en stark bas blandas med en eller flera fettsyror. Alkaliskt betyder basiskt. Vi tvåltillverkning används två olika baser, natriumhydroxid och kaliumhydroxid. När man använder natriumhydroxid blir tvålen fast och vid kaliumhydroxid blir tvålen mer som en gelé, vilket är det som används vid tillverkning av flytande tvål. Anledningen till att de två olika hydroxiderna skapar olika konsistens på tvål är att natrium är en hårdare metall än kalium.
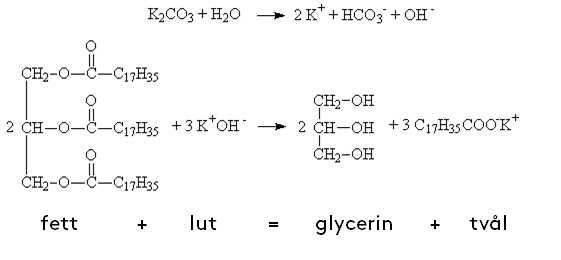
Det kan låta skrämmande med starkt basiskt och frätande men inget av det finns kvar i tvålen. Fettet och luten omformateras till två nya ämnen, tvål och glycerin.
Vad är det då som händer när fettsyrorna möter basen?
Oljan och/eller fettet är en ester bestående av en triglycerid vilket betyder att det är tre fettsyremolekyler bundna till en glycerolmolekyl. Den hydrolyseras vid reaktionen och det bildas glycerin och fettsyra. Hydrolys är en kemiskprocess som innebär att en bindning av en molekyl bryts på samma gång som den reagerar med vatten. Till fettsyran då som är negativt laddad och bildar ett alkaliskt salt tillsammans med natrium eller kaliumjoner (beroende på vilken bas som använts). Tvål och glycerin blir till.
Olika oljor ger olika resultat
Oljor och fetter är som tvålmakarens färger på en palett, alla går att blanda med olika vackert resultat. För att sätta ihop ett bra tvålrecept kollar tvålmakaren på vilka fettsyror varje önskad olja innehåller och kan då skapa sig en uppfattning om hur den färdiga tvålen kommer att bli. Fettsyresammansättningen påverkar hårdheten på tvålen, hur tvålsmeten är att jobba med, hur löddret kommer att kännas och vilka hudvårdande egenskaper tvålen får. En stor del i konsten att kunna tvålmaka ligger i receptgörandet.
Förtvålningstal
Beroende på vilken fettsyresammansättning en olja har behövs olika mycket natriumhydroxid eller kaliumhydroxid för att om formatera oljan till tvål och glycerin.
Metoden att kunna räkna ut förtvålningstal är sedan 1800talet och i tvålsammanhang ny, innan går en sägen om ett härligt trick där man helt enkelt lade ett rått ägg i den hemmagjorda luten och om ägget flöt var luten stark nog till tvål. Tvåla & Tvaga rekommenderar att räkna med förtvålningstal vid tvåltillverkning.
Ph värde i tvål
Tvål är ett basiskt salt. Ph-värdet varierar mellan 8.5-10. Neutralt ph är 7 och hudens är omkring 5. Att tvålen är lätt basisk är inget som stör din hud sålänge den är en naturtvål, alltså har kvar sitt naturliga fuktighetsbevarande glycerin, och att den är överfettad. Överfettningen och glyceringen ger nämligen en snabb ph-korringering.
Men var ifrån kommer då det lätt basiska ph.värdet i tvålen och vad styr den? Oljan/fettet är inte vattenlösligt och har därför inget ph-värde men oljan/fettet består till största del av fettsyror som höres är syror så när tvålen och glycerinet skapas kan man säga att fettsyrorna tämjer, eller neutraliserar basen som har ett ph-värde runt 13 i sin rena form. Neutraliseringen sker underförtvålningen i hydrolysen där tvålen och glycerinet blir till.
Faktaruta Glycerin
INCI namn: glycerin
Varför finns det i tvål: I hantverkstvål skapas det naturligt under förtvålningen, verkar fruktbringande och fuktgivande åt huden. I industriellt tillverkad tvål tillsätts glycerin i efterhand.
Först att reda ut; glycerin och glycerol är samma sak och är ett fuktighetsbindande ämne kemiskt sett en alkohol. Glycerin finns naturligt i vår hud och lite överallt i naturen även i liten mängd i oljor och fetter. I en kallrörd tvål skapas naturligt mellan 9-ca14% glycerin vid förtvålning som sedan ligger bundet i tvålen. I varmrörd tvåltillverkningsmetod fäller glycerinet ut sig av sig självt och tas tillvara på, i bra tvål tillsätts det igen och i en sämre används det åt annat. I tvåltillverkningsmetod där man pressar en redan förtvålad tvålmassa tillsätts glycerin tillsammans med doft och andra tillsatser innan tvålmassan går genom pressning.
Glycerin ingår i många kosmetiska produkter som krämer och makeup för att bibehålla fukt och ge rätt konsistens. Just glycerinet tillverkat genom förtvålning av oljor är extra åtråvärt och bra i kvalitén.
Faktaruta Kaliumhydroxid
INCI namn: potassium hydroxide
Kännetäcken: starkt frätande bad lättlöslig i vatten. Kommer i form av flakes eller pärlor.
Egenskap i tvål: Skapar en såpa istället för fast tvål.
Pottaska är något som nämns ibland och heter egentligen kaliumkarbonat, är föregångaren till kaliumhydroxid och det som användes vid såpsjuderierna år 1600 och framåt för att tillverka såpa.
Anledningen till att natriumhydroxid och kaliumhydroxid skapar olika konstistens på det färdiga tvålämnet är att natrium är en hårdare metall än kalium.
Faktaruta natriumhydroxid
INCI namn: sodium hydroxide
Kännetecken: starkt frätande bas lättlöslig i vatten. Kommer i pärlform.
Egenskap i tvål: Nyckelämne i tillverkning av fasttvål. Ingen tvål i den bemärkelsen äkta tvål menas kan bli till utan natriumhydroxid. Viktigt att nämna är att inget av det farliga frätande finns kvar i den färdiga tvålen.
NaOH är en bas som ger ifrån sig hydroxidjoner i vattenlösning. Ämnet är starkt frätande både i löst och olöst form. I tvåltillverkning används en lösning av natriumhydroxid i vatten. NaOH framställs genom en elektrolys då man leder ström genom en vattenlösning av koksalt varefter lösningen dunstas in till fast form för att sen renas med alkohol. Processen kallas klorakalimetoden. Den natriumhydroxiden Tvåla & Tvaga använder är framställd i labb på en kemtekniskfabrik i Tyskland. Det är viktigt som tvålmakare att säkerställa renheten på sin natriumhydroxid för att kunna få ett jämt och säkert resultat i tillverkning och en renhet på minst 99% rekommenderas.
För längesedan redan så tidigt som ca 3000f.kr tillverkade Egypterna starka baser mycket liknande natriumhydroxid och användes på samma vis. Soda, natriumkarbonat var vanligast och man utvann det genom beredning av askträ. Även idag kan man tillverka egen natirumhydroxid genom att låta vatten rinna sakta genom askatträ. Den natriumhydroxiden vi känner till idag såg sitt ljus först år 1755 då man lyckas utvinna natriumhydroxid ut natriumkarbonat. Innan dess gjorde man oftast ingen skillnad på de olika alkalierna och gjorde man det så var det kalilut som användes till såpa eller mineraliskt kali som blev bäst till fast tvål. Det är spännande att tänka på hur tvålen och såpan var förr och med stor sannolikhet satt känslan för hantverket i händerna och mängden av råvaror som behövdes var något man lärde sig av en mer erfaren. Innan dess
Samma NaOH som gjord i labb, bara mindre ren och kontrollerad går att utvinna ur förkolnat trä som vatten får rinna genom, det var så man framställde sin natirumhydroxidlösning förr.
Lut = natriumhydroxid, soda eller kaliumhydroxid löst i vatten.